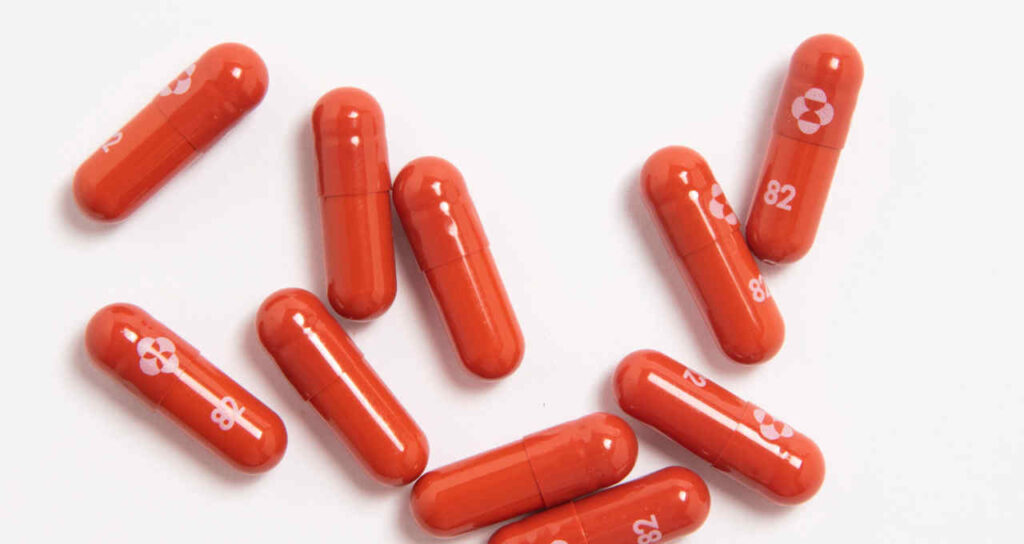
Reino Unido aprova pílula antiviral contra covid-19 – Medicamento Molnupiravir recebe autorização condicional para adultos com covid-19 e ao menos um fator de risco. Droga da farmacêutica alemã Merck é a primeira pílula comprovadamente eficaz no tratamento anticovid.O Reino Unido concedeu autorização condicional à primeira pílula comprovadamente eficaz no tratamento contra a covid-19, nesta quinta-feira (04/11). O governo britânico é assim a primeira autoridade nacional a aprovar o tratamento da farmacêutica alemã Merck. No entanto não divulgou detalhes sobre quando a pílula estaria disponível no mercado.
O Molnupiravir foi licenciado para adultos a partir de 18 anos que testaram positivo para covid-19 e que tenham pelo menos um fator de risco para desenvolver doenças graves, como obesidade ou problemas cardíacos. Pacientes com sintomas leves a moderados de covid-19 tomariam quatro comprimidos duas vezes ao dia, durante cinco dias.
“Hoje é um dia histórico para o nosso país, pois o Reino Unido é agora o primeiro do mundo a aprovar um antiviral contra a covid-19 que pode ser levado para casa”, disse o secretário da Saúde britânico, Sajid Javid. “Estamos trabalhando em ritmo acelerado em todo o governo e com o NHS [Serviço Nacional de Saúde] a fim de definir planos para aplicar o Molnupiravir em pacientes, por meio de um estudo nacional, o mais rápido possível”, afirmou Javid.
Um antiviral capaz de reduzir sintomas e acelerar a recuperação pode ser um marco inovador no combate ao coronavírus, diminuindo o número de casos em hospitais e ajudando a conter surtos em países mais pobres, com sistemas de saúde frágeis. Também reforçaria a abordagem da pandemia em duas frentes: tratamento, por meio de medicamentos, e prevenção, especialmente por meio de imunizações. Médicos afirmaram que o tratamento com o Molnupiravir seria particularmente significativo para quem não responde bem à vacinação.
Produção limitada e muitos interessados No entanto os suprimentos iniciais serão limitados. A farmacêutica Merck informou que pode produzir 10 milhões de tratamentos – ou seja, 400 milhões de pílulas – até o fim de 2021, mas grande parte desse fornecimento já foi comprado por governos de todo o mundo. Em outubro, autoridades do Reino Unido anunciaram que garantiram 480 mil complexos de tratamento do Molnupiravir, e estimavam que no inverno milhares de britânicos vulneráveis deveriam ter acesso a eles, através de um estudo nacional.
O Molnupiravir aguarda a conclusão de análises de reguladores sanitários nos Estados Unidos e na União Europeia (UE), entre outros. O órgão americano Food and Drug Administration (FDA) anunciou que organizara para novembro um painel de especialistas independentes incumbidos de examinar a segurança e eficácia da pílula da Merck. Menos 50% hospitalizações e mortes A Merck e o laboratório parceiro Ridgeback Biotherapeutics solicitaram a reguladores de todo o mundo a autorização para o Molnupiravir para adultos com casos iniciais de covid-19, que estejam em riso de desenvolver doenças graves ou hospitalização.
Este é aproximadamente o mesmo grupo-alvo para o tratamento com drogas com anticorpos injetáveis, padrão de tratamento em muitos países para os pacientes com covid-19 que ainda não necessitem ser hospitalizados. Em setembro, a Merck dvulgou resultados preliminares, segundo os quais a pílula cortou pela metade as hospitalizações e mortes entre pacientes com sintomas iniciais de covid-19. Os resultados ainda não foram revisados por pares ou publicados numa revista científica.
A farmacêutica tampouco divulgou detalhes sobre os efeitos colaterais do Molnupiravir, comentando apenas que as taxas de sintomas subsequentes foram semelhantes entre os que receberam a pílula e os que receberam um placebo. Debate sobre alterações genéticas O Molnupiravir ataca uma enzima que o novo coronavírus usa para se reproduzir e distorce seu código genético, o que diminui sua capacidade de se propagar e dominar mais células.
Essa atividade genética levou alguns especialistas independentes a questionarem se a droga poderia causar mutações que levassem a defeitos de nascença ou tumores. A Agência Reguladora de Medicamento e Produtos de Saúde do Reino Unido afirmou que a capacidade do Molnupiravir de interagir com o DNA e causar mutações foi estudada “extensivamente”, não tendo sido considerada um risco para os humanos.
“Estudos em ratos mostraram que [o Molnupiravir] pode causar efeitos prejudiciais à prole não nascida, embora em doses maiores do que as que serão administradas a humanos, e esses efeitos não foram observados em outros animais”, afirmou a agência britânica.
No estudo da Merck, tanto homens quanto mulheres foram instruídos a usarem anticoncepcionais ou a se abster de relações sexuais. Mulheres grávidas foram excluídas do estudo. A Merck sustenta que o medicamento é seguro se usado conforme as instruções.
O Molnupiravir foi inicialmente estudado como potencial terapia para a gripe, num projeto financiado pelo governo dos EUA. Em 2020, pesquisadores da Emory University decidiram redirecionar a droga como potencial tratamento para a covid-19, e a licenciaram para a Ridgeback Biotherapeutics e Merck.
Fonte: Notícias Uol